hóa học
Định luật cân bằng hóa học mô tả thành phần của các chất khác nhau, dựa trên mối quan hệ (về khối lượng) giữa mỗi loài can thiệp vào phản ứng. Tất cả các vật chất hiện có được hình thành bởi sự kết hợp, theo tỷ lệ khác nhau, của các nguyên tố hóa học khác nhau tạo nên bảng tuần hoàn. Các công đoàn này được điều chỉnh bởi các định luật kết hợp nhất định được gọi là "định luậ
Ethanamide là một chất hóa học thuộc nhóm các hợp chất nitơ hữu cơ. Nó cũng nhận được tên của acetamide, theo Liên minh Hóa học thuần túy và ứng dụng quốc tế (IUPAC cho từ viết tắt bằng tiếng Anh). Thương mại nó được gọi là amit axit axetic. Nó được gọi là amide vì nitơ được gắn vào một nhóm carbonyl. Nó là
Phản ứng Maillard là tên được đặt cho các phản ứng hóa học giữa các axit amin và đường khử làm che khuất thức ăn trong quá trình rang, nướng, rang và chiên. Các hợp chất màu nâu được hình thành chịu trách nhiệm cho màu sắc và mùi thơm của các sản phẩm như vỏ bánh mì, thịt bò nướng, khoai tây chiên và bánh quy nướng. Phản ứng được ưa thích bởi nhiệt (nhiệt độ từ 140 đến 165 ˚C), mặc dù nó cũng xảy ra ở tốc
Nhôm clorua hoặc nhôm trichloride (AlCl3) là một muối nhị phân được hình thành bởi nhôm và clo. Đôi khi nó xuất hiện dưới dạng bột màu vàng vì nó có tạp chất do sự hiện diện của clorua sắt (III). Nó có được bằng cách kết hợp các yếu tố của nó. Nhôm, có ba electron ở mức năng lượng cuối cùng (họ IIIA), có xu hướng tạo
Axit carboxylic là một thuật ngữ được quy cho bất kỳ hợp chất hữu cơ nào có chứa một nhóm carboxyl. Chúng cũng có thể được gọi là axit hữu cơ, và có mặt trong nhiều nguồn tự nhiên. Ví dụ, axit formic, một axit carboxylic, được chưng cất từ kiến và các côn trùng khác như bọ cánh cứng galerita. Đó là, một con kiến là một nguồn axit formic phong phú. Ngoài ra, giấm được chiết xuất
Axit Alendronic là một hợp chất hữu cơ thuộc phân loại bisphosphonates, đặc biệt là các thế hệ thứ hai; Đây là những chất có chứa nguyên tử nitơ. Hợp chất này, cũng như phần còn lại của bisphosphonates, có cấu trúc tương tự cao với pyrophosphate vô cơ (PPi). Pyrophosphate vô cơ là sản phẩm của nhiều phản ứng tổng hợp trong
Axit formic hoặc axit methanoic Nó là hợp chất đơn giản và nhỏ nhất trong tất cả các axit hữu cơ. Nó còn được gọi là axit methanoic và công thức phân tử của nó là HCOOH, chỉ có một nguyên tử hydro liên kết với nguyên tử carbon. Tên của nó bắt nguồn từ từ formica , trong tiếng Latin có nghĩa là kiến. Các nhà tự nhiên học thế kỷ 15 đã phát hiện ra rằng một số loại côn trùng (for
Axit tartaric là một hợp chất hữu cơ có công thức phân tử là COOH (CHOH) 2 COOH. Nó có hai nhóm carboxyl; nghĩa là, nó có thể giải phóng hai proton (H +). Nói cách khác, nó là một axit lưỡng cực. Ngoài ra, nó có thể được phân loại là một axit alderic (đường axit) và một dẫn xuất axit succinic. Muối của nó được biết đến từ thời xa xưa và là một trong những sản
Canxi clorua (CaCl 2) Nó là một loại muối vô cơ bao gồm canxi, kim loại kiềm thổ và clo clo. Trong hợp chất đó, có một số tương tác tĩnh điện xác định hình dạng bên ngoài của các tinh thể của nó và phần còn lại của các tính chất vật lý của chúng. Ngoài ra, nó luôn đi kèm với các phân tử nước, tạo thành hydrat có côn
Phản ứng tỏa nhiệt là một loại phản ứng hóa học trong đó xảy ra sự truyền năng lượng, chủ yếu dưới dạng giải phóng nhiệt hoặc ánh sáng. Tên này xuất phát từ tiền tố Hy Lạp exo , có nghĩa là "ra bên ngoài"; và thuật ngữ "nhiệt", dùng để chỉ nhiệt hoặc nhiệt độ. Theo nghĩa này, các phản ứng tỏa nhiệt có thể truyền các loại năng lượng khác vào môi tr
Các giải pháp hóa học là những gì được gọi là hỗn hợp đồng nhất trong hóa học. Chúng là hỗn hợp ổn định của hai hoặc nhiều chất trong đó một chất (gọi là chất tan) hòa tan vào chất khác (gọi là dung môi). Các giải pháp thông qua pha của dung môi trong hỗn hợp và có thể tồn tại trong các pha rắn, lỏng và khí. Trong tự nhiên có hai loại hỗn hợp: hỗn hợp không đồng nhất và hỗn hợp đồng nhất. Hỗn hợp khôn
Quá trình nhiệt phân bao gồm một quá trình phân hủy nhiệt trong đó các chất có nguồn gốc hữu cơ trong phần lớn của nó - chịu nhiệt độ cao trong môi trường trơ (không có oxy). Khi chất hữu cơ được xử lý bằng phương pháp nhiệt phân, thu được các sản phẩm được sử dụng trong lĩnh vực công nghiệp. Một trong những yếu tố có thể thu được là than cốc, được sử dụng như một loại nhiên liệu có đặc
Nhiệt hóa học chịu trách nhiệm nghiên cứu các biến đổi nhiệt lượng được thực hiện trong các phản ứng giữa hai hoặc nhiều loài. Nó được coi là một phần thiết yếu của nhiệt động lực học, nghiên cứu sự biến đổi nhiệt và các loại năng lượng khác để hiểu hướng mà quá trình phát triển và năng lượng của chúng thay đổi như thế nào. Ngoài ra, điều cần thiết là phải hiểu rằng nhiệt liên quan đến việc truyền năng lượng nhiệt xảy ra giữa hai cơ thể, k
Kali nitrat là một loại muối ternary bao gồm kali, kim loại kiềm và nitrat oxoener. Công thức hóa học của nó là KNO 3 , có nghĩa là với mỗi ion K +, có một ion NO 3 - tương tác với nó. Do đó, nó là một muối ion và tạo thành một trong những nitrat kiềm (LiNO 3 , NaNO 3 , RbNO 3 ...). KNO 3 là một tác nhân oxy hóa mạnh do sự hiện diện c
Diphenylamine là một hợp chất hữu cơ có công thức hóa học là (C 6 H 5 ) 2 NH. Tên của nó chỉ ra rằng nó là một amin, cũng như công thức của nó (-NH 2 ). Mặt khác, thuật ngữ "diphenyl" dùng để chỉ sự hiện diện của hai vòng thơm liên kết với nitơ. Theo đó, diphenylamine là một amin thơm. Trong thế giới của các h
Strontium clorua là một hợp chất vô cơ được hình thành bởi strontium, kim loại kiềm thổ (Mr. Becamgbara) và halogen clo. Do cả hai nguyên tố này đều có độ âm điện rất khác nhau, nên hợp chất là chất rắn ion có công thức hóa học là SrCl 2 . Vì nó là một chất rắn ion, nó được cấu thành bởi các ion. Đố
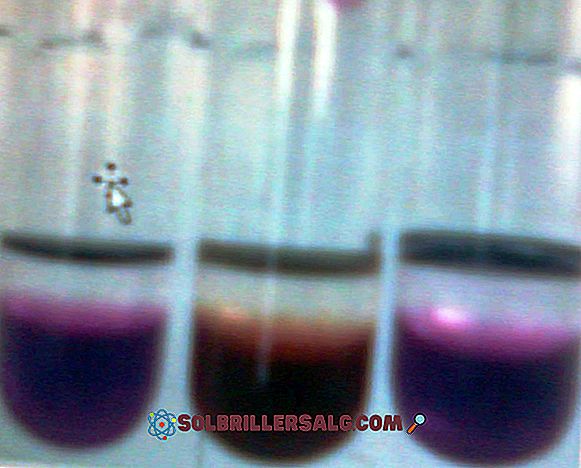
Phenolphthalein là thuốc nhuộm hữu cơ, lần lượt là một axit lưỡng cực yếu, được sử dụng trong nhiều phép xác định thể tích như là một chỉ thị axit-bazơ. Đó là, nếu là axit lưỡng cực, trong dung dịch, nó có thể mất hai ion H + và để trở thành một chỉ số, nó phải có đặc tính là có màu trong phạm vi pH được đánh giá. Trong môi trường cơ bản (pH> 8) phenolphthalein có màu hồng, có thể được tăng cường thành màu đỏ
Kali permanganat (KMnO 4) là một hợp chất vô cơ được hình thành bởi mangan - nhóm kim loại chuyển tiếp 7 (VIIB) -, oxy và kali. Nó là một chất rắn thủy tinh màu tím sẫm. Dung dịch nước của chúng cũng có màu tím đậm; Những dung dịch này trở nên ít màu tím hơn khi chúng được pha loãng trong một lượng nước lớn hơn. Sau đó, KMnO 4 bắt đầu trải qua quá trình khử (tăng electron) liên tiếp các màu t
Strontium oxide , có công thức hóa học là SrO (không bị nhầm lẫn với strontium peroxide, là SrO2), là sản phẩm của phản ứng oxy hóa giữa kim loại này và oxy có trong không khí ở nhiệt độ phòng: 2Sr (s) + Ôxy (g) → 2SrO (s). Một mảnh strontium cháy tiếp xúc với không khí là kết quả của khả năng phản ứng cao của nó, và vì nó có cấu hình điện tử của loại ns2, nó dễ dàng tạo ra hai electron hóa trị, đặc biệt là phân tử diatomic oxy. Nếu diện tích bề mặt của kim loại tăng lên bằng cách phun nó vào một loại bột được chia nhỏ, phản ứng xảy ra ng
Electron khác biệt hoặc khác biệt là electron cuối cùng được đặt trong chuỗi cấu hình điện tử của nguyên tử. Tại sao tên của anh ấy? Để trả lời câu hỏi này, cấu trúc cơ bản của một nguyên tử là cần thiết: hạt nhân, chân không và electron của nó. Hạt nhân là một tập hợp dày đặc, nhỏ gọn của các hạt dương gọi là proton và c
Hydroxyapatite là một khoáng chất canxi phốt phát, có công thức hóa học là Ca 10 (PO 4 ) 6 (OH) 2 . Cùng với các khoáng chất và chất hữu cơ khác vẫn bị nghiền nát và nén chặt, nó tạo thành nguyên liệu thô được gọi là đá photphoric. Thuật ngữ "hydroxy" dùng để chỉ anion OH-. Nếu thay vì anion đó là florua, khoáng chất sẽ được gọi là fluoroap
Magiê phốt phát là một thuật ngữ được sử dụng để chỉ một họ các hợp chất vô cơ được hình thành bởi magiê, kim loại kiềm thổ và phốt phát oxoener. Magiê phốt phát đơn giản nhất có công thức hóa học Mg 3 (PO 4 ) 2 . Công thức chỉ ra rằng cứ hai anion PO 4 3- thì có ba cation Mg2 + tương tác với chúng. Ngoài ra, các hợp chất này có thể được mô tả là muối magiê có nguồn gốc từ axit orthop
Thủy tinh Pyrex là một loại thủy tinh borosilicate đặc biệt có thương hiệu (Pyrex) xuất hiện tại thành phố New York năm 1915, được sản xuất bởi Corning Glass. Nó nổi lên như một vật liệu cho bao bì thực phẩm hiện đại, cũng được sử dụng để lưu trữ và nướng thực phẩm trong cùng một loại hộp đựng. Nguồn gốc của từ Pyrex đã tạo ra một số khác biệt nhất định, nhưng người ta chấp nhận rằng
Enantiomers là những cặp hợp chất hữu cơ (và vô cơ) bao gồm hai hình ảnh phản chiếu không thể chồng lên nhau. Khi điều ngược lại xảy ra - ví dụ, trong trường hợp bóng, gậy đánh gôn hoặc nĩa - chúng được gọi là vật thể achirin. Thuật ngữ chirality được đặt ra bởi William Thomson (Lord Kelvin), người đã xác định rằng một vật thể là chuler nếu nó không thể trùng với hình ảnh phản chiếu của nó. Ví dụ, bàn tay là các yếu tố đối kháng, bởi vì sự phản chiếu của bàn tay trái, mặc dù nó quay, sẽ không bao giờ trùng
Kim loại màu là tất cả những kim loại thiếu hoặc có lượng sắt không đáng kể. Chúng, với tỷ lệ khối lượng khác nhau, được sử dụng để tạo ra các hợp kim thể hiện tính chất vật lý tốt hơn so với các kim loại riêng lẻ. Do đó, cấu trúc tinh thể và tương tác kim loại của nó là nền tảng của các ứng dụng của hợp kim không chứa sắt. Tuy nhiên, những kim loại nguyên chất này tìm thấy ít sử dụng hơn vì chúng rất nhạy cảm và phản ứng. Vì lý do nà
Kết tủa hoặc kết tủa hóa học là một quá trình bao gồm sự hình thành một chất rắn không hòa tan từ hỗn hợp của hai dung dịch đồng nhất. Không giống như mưa và tuyết, trong loại mưa này "trời mưa đặc" từ bề mặt chất lỏng. Trong hai dung dịch đồng nhất, các ion được hòa tan trong nước. Khi chúng
Đặc tính kim loại của các nguyên tố của bảng tuần hoàn đề cập đến tất cả các biến, hóa học và vật lý, xác định kim loại hoặc phân biệt chúng với các chất khác của tự nhiên. Chúng thường sáng, đậm đặc, chất rắn cứng, có độ dẫn nhiệt và điện cao, có thể đúc và dễ uốn. Tuy nhiên, không phải tất cả các kim loại thể hiện các đặc tính như vậy; ví dụ, trong trường hợp thủy
Các muối diazonium là các hợp chất hữu cơ trong đó có tương tác ion giữa nhóm azo (-N 2 +) và anion X- (Cl-, F-, CH 3 COO-, v.v.). Công thức hóa học chung của nó là RN 2 + X-, và trong chuỗi này, chuỗi bên R có thể là nhóm aliphatic hoặc nhóm aryl; đó là một vòng thơm. Cấu trúc của ion arenodiazonium được thể hiện trong
Kim loại màu là những kim loại có chứa sắt (Fe), cũng như một lượng nhỏ kim loại khác được thêm vào để mang lại những đặc tính có lợi nhất định cho hợp kim của chúng. Mặc dù sắt có thể tồn tại ở các trạng thái oxy hóa khác nhau, +2 (kim loại) và +3 (sắt) là phổ biến nhất. Tuy nhiên, thuật ngữ "kim loại" dùng để chỉ sự hiện diện của sắt bất kể trạ
Lý thuyết ban nhạc là một trong đó xác định cấu trúc điện tử của vật rắn nói chung. Nó có thể được áp dụng cho bất kỳ loại chất rắn nào, nhưng nó nằm trong kim loại nơi những thành công lớn nhất của nó được phản ánh. Theo lý thuyết này, liên kết kim loại là kết quả của lực hút tĩnh điện giữa các ion tích điện dương và các electron di động trong tinh thể. Do đó, tinh thể kim loại có "biển electron", có thể giải thích các tính chất vật lý của nó. Hình ảnh th