hóa học
Nước Alibour , còn được gọi là Agua D'Alibour, là một sản phẩm dược phẩm dạng lỏng và màu xanh nhạt với mùi nhẹ của long não. Thành phần chính của nó là kẽm sulfat, nghệ tây và đồng sunfat, trộn trong nước. Người ta tin rằng nước alibour là một thành phần tốt để điều trị các vấn đề về da như mụn trứng cá và bỏng, vì vậy nó cũng được coi là một trong những yếu tố chính của thuốc tại nhà. Mặc dù không có nghi ngờ về lợi ích của chất lỏng này, người ta cũng biết rằng việc tiêu thụ vô tình của nó có thể gây nguy hi
Acaroin , còn được gọi là "chất lỏng Manchester", "zotal" và "creolina", là một chất khử trùng tự nhiên và chất diệt khuẩn có nguồn gốc từ quá trình chưng cất gỗ. Thành phần chính của nó là phenol, được gây ra bởi quá trình oxy hóa benzen. Bởi vì nó là một hợp chất mạnh mẽ, nó chủ yếu được sử dụng tr
Cadmium hydroxide (Cd (OH) 2 ) là một chất có nguồn gốc vô cơ, được đặc trưng bởi ở trạng thái kết tập rắn, ở dạng tinh thể trắng. Nó là một chất có bản chất ion với cấu trúc tinh thể thuộc loại hình lục giác, tạo thành một hydroxit có hành vi lưỡng tính. Theo nghĩa này, cadmium hydroxide có thể được sản xuất theo nhiều cách khác
Axit photphoric là một axit oxo của phốt pho có công thức hóa học H 3 PO 4 . Nó bao gồm một axit khoáng trong đó ba proton axit được liên kết với anion phốt phát (PO 4 3-). Mặc dù nó không được coi là một axit mạnh, nhưng việc sử dụng không phù hợp có thể gây nguy cơ cho sức khỏe. Nó có thể được tìm thấy ở hai trạng thái: như một chất rắn ở dạng
Chromium (Cr) là một nguyên tố kim loại thuộc nhóm 6 (VIB) của bảng tuần hoàn. Hàng năm, hàng tấn kim loại này được sản xuất bằng cách chiết xuất quặng sắt crôm hoặc quặng magiê (FeCr 2 O 4 , MgCr 2 O 4 ), được khử bằng carbon để thu được kim loại. Nó rất dễ phản ứng, và chỉ trong điều kiện rất giảm là nó ở dạng n
Kẽm hydroxit (Z n (OH) 2) được coi là một chất hóa học có tính chất vô cơ, chỉ bao gồm ba nguyên tố: kẽm, hydro và oxy. Nó có thể được tìm thấy một cách hiếm hoi trong tự nhiên, ở dạng rắn kết tinh khác nhau của ba khoáng chất khó tìm thấy, được gọi là sweetita, ashoverita và wülfingita. Mỗi dạng đa hình này có các đặc tính nội tại với bản chất của chúng, mặc d
Beryllium hydroxide là một hợp chất hóa học được tạo thành từ hai phân tử hydroxit (OH) và một phân tử beryllium (Be). Công thức hóa học của nó là Be (OH) 2 và được đặc trưng như một loài lưỡng tính. Nói chung, có thể thu được từ phản ứng giữa beryllium monoxide và nước, theo phản ứng hóa học sau: BeO + H 2 O → Be (OH) 2 Mặt khác, chất lưỡng tính này có cấu hình phân tử thuộc loại tuyến tính. Tuy nhiên, các cấu trúc khác nhau của beryllium hydroxide có thể thu được: dạng alpha và beta, dưới dạng k
Bình chưng cất , bình cầu hoặc bóng chưng cất là một trong nhiều loại bình thủy tinh được sử dụng trong phòng thí nghiệm để thực hiện quá trình chưng cất trong các hợp chất hóa học ở pha lỏng. Theo cách tương tự, thiết kế của nó dựa trên việc đạt được sự phân tách mẫu tốt nhất có thể được phân tích, cho phép phân phối nhiệt đồng đều, kiểm soát sôi tối đa và chưng cất chất lỏng hiệu quả. Ở cấp độ phòng thí nghiệm, việc tách hỗn hợp các chất khác nhau thường là cần thiết, để làm sạch mẫu hoặc để thu được các thành phầ
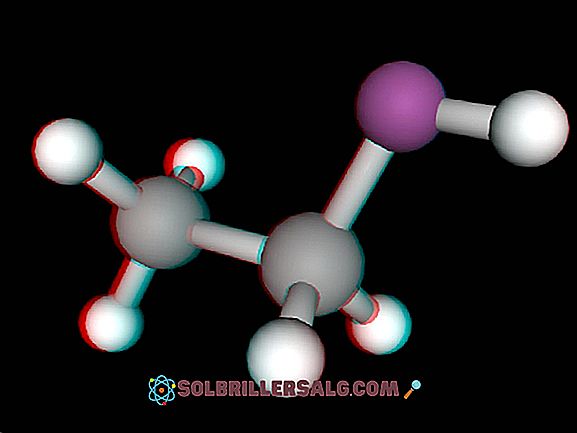
Ethane là một hydrocarbon đơn giản có công thức C 2 H 6 với bản chất khí không màu và không mùi, có công dụng rất đa dạng và có giá trị trong quá trình tổng hợp ethylene. Ngoài ra, nó là một trong những loại khí trên mặt đất cũng đã được phát hiện trong các hành tinh và các ngôi sao khác xung quanh Hệ Mặt Trời. Nó được phát hiện bởi nhà khoa học Michael Faraday vào năm 1834. Trong số lượng
Aldehyd là các hợp chất hữu cơ có công thức chung RCHO. R đại diện cho một chuỗi aliphatic hoặc thơm; C thành carbon; Hoặc oxy và H thành hydro. Chúng được đặc trưng bởi có một nhóm carbonyl cũng như ketone và axit carboxylic, do đó aldehyd còn được gọi là hợp chất carbonyl. Nhóm carbonyl cung cấp cho aldehyd nhiều tính chất của nó. C
Strontium hydroxide (Sr (OH)) là một hợp chất hóa học vô cơ bao gồm ion strontium (Sr) và hai ion hydroxide (OH). Hợp chất này thu được bằng cách kết hợp muối strontium với một bazơ mạnh, dẫn đến một hợp chất có tính kiềm có công thức hóa học là Sr (OH) 2 . Nói chung, natri hydroxit (NaOH) hoặc kali hydroxit (KOH) đượ
Liên kết cộng hóa trị không phân cực là một loại liên kết hóa học trong đó hai nguyên tử có độ âm điện tương tự chia sẻ các electron để tạo thành một phân tử. Nó được tìm thấy trong một số lượng lớn các hợp chất có các đặc điểm khác nhau, nằm giữa hai nguyên tử nitơ tạo thành các loại khí (N 2 ) và giữa các nguyên tử carbon và hydro giữ phân tử khí metan (CH 4 ), cũng như trong số nhiều chất khác. Nó được gọi là độ âm điện đối với tài sản được sở hữu bởi các nguyên tố hóa học đề cập đến khả năng của các loài nguyên t
Axit cloic là một hợp chất vô cơ có công thức HClO 2 . Axit cho biết là một trong những axit oxacid của clo, nơi nó được tìm thấy với trạng thái oxy hóa 3+. Mặc dù axit khó thu được trong chất nguyên chất, bazơ liên hợp có nguồn gốc từ các axit này, ion chlorite, ổn định. Một ví dụ về muối của anion này là natri clorit nổi tiếng. Điều nà
Axit perbromic hoặc axit tetraoxo brómico là một hợp chất vô cơ có công thức HBrO 4 . Cấu trúc của nó được trình bày trong Hình 1 (EMBL-EBI, 2007). Nó là một axit oxacid brôm, nơi nó có trạng thái oxy hóa 7+. Nó không ổn định và không thể được hình thành do sự dịch chuyển của clo axit perchloric, vì axit đã được điều chế; nó chỉ có thể được thực hiện bằng cách tạo ra ion perbromate. Axit perbromic là một axit mạnh và tác nhân oxy hóa mạnh mẽ. Nó là kém bền nhất của các oxit ha
Amoni clorua , còn được gọi là muối ammoniac, là một loại muối vô cơ có trong nước tiểu có công thức là NH 4 Cl. Nó được tìm thấy trong các thành phần khoáng vật học và ở dạng này được gọi là muối amoniac. Nó cũng đã được tìm thấy trong một số lỗ thông hơi và tro núi lửa. Nó có thể thu được bằng các phương pháp khác nhau. Đầu tiên là thông qua quá trình
Kali oxit , còn được gọi là oxit kali, là một ion oxy và muối kali có công thức là K 2 O. Cấu trúc của nó được trình bày trong Hình 1 (EMBL-EBI, 2016). K 2 O là kali oxit đơn giản nhất, nó là một hợp chất có khả năng phản ứng cao và hiếm khi được tìm thấy. Một số vật liệu thương mại, chẳng hạn như phân bón và xi măng,
Axit Hypohydoic, còn được gọi là monoxoiodate (I) của hydro hoặc iodol, là một hợp chất vô cơ có công thức HIO. Nó là một oxacid iốt, với một nguyên tử oxy, một nguyên tử hydro và một nguyên tử iốt có trạng thái oxy hóa 1+. Hợp chất rất không ổn định vì nó có xu hướng trải qua phản ứng phân hủy trong đó nó bị khử thành iốt phân tử và bị oxy hóa thành axit và iốt theo phản ứng: 5HIO → 2I 2 + HIO 3 + 2H 2 O. Hợp chất là axit yếu nhất của các oxit halogen với trạng thái oxy hóa 1+. Các muối tương ứng của axit này đư
Kẽm oxit là một hợp chất hóa học có công thức ZnO. Nó là một hợp chất hóa học vô cơ được sử dụng như một thành phần trong các loại thuốc không kê đơn. Nó cũng được sử dụng chủ yếu như một chất phụ gia trong các sắc tố và chất bán dẫn trong các ngành công nghiệp khác nhau. Kẽm oxit được tìm thấy trong tự nhiên trong kẽmite, một khoáng chất chủ yếu được tìm thấ
Axit propanic là một axit béo chuỗi ngắn bão hòa bao gồm ethane gắn với carbon của một nhóm carboxy. Công thức của nó là CH 3 -CH 2 -COOH. Anion CH3CH2COO- cũng như các muối và este của axit propanoic được gọi là propionat (hoặc propanoat). Nó có thể thu được từ dư lượng bột gỗ bằng quá trình lên men bằng cách sử dụng vi khuẩn thuộc chi propionibacterium . Nó cũng thu được từ ethanol và carbon monoxide sử dụng chất xúc tác boron tri
Kali ferrocyanide , còn được gọi là kali hexacyanoferrate (II) hoặc vàng Phổ, là một hợp chất vô cơ có công thức K 4 [Fe (CN) 6 ]. Nó là muối kali của phức hợp phối hợp ferrocyanide (Fe (CN) 6 4-) và thường được tìm thấy ở dạng trihydrated K 4 [Fe (CN) 6 ] · H 2 O. Cấu trúc của nó được thể hiện trong hình 1 (EMBL-EBI,
Axit Hypochlorous , còn được gọi là axit monoxocloric (I), là một hợp chất hóa học có công thức HClO. Nó là một phân tử đơn giản với oxy trung tâm kết nối với các nguyên tử clo và hydro thông qua các liên kết đơn giản. Nó là một oxacid clo, có hóa trị (I). Nó là một axit yếu thường được hình thành khi clo hòa tan tron
Natri hydroxit , còn được gọi là thuốc tẩy, xút hoặc xút, là một hợp chất hóa học có công thức NaOH, tạo thành dung dịch kiềm mạnh khi hòa tan trong dung môi như nước. Caustic soda được sử dụng rộng rãi trong nhiều ngành công nghiệp, đặc biệt là một cơ sở hóa học mạnh trong sản xuất bột giấy và giấy, dệt may, nước uống, xà phòng và chất tẩy rửa. Cấu trúc của nó được thể hiện trong hình 1. Theo Rachel Golearn, sản lượng thế giới năm 1998 xấp xỉ 45
Hydrogen sulfide là tên gọi chung của hydro sulfide (H 2 S). Nó có thể được coi là một axit hydrazide trong dung dịch (H 2 S (aq)). Việc xem xét axit sulfhydryl được đưa ra mặc dù độ hòa tan thấp trong nước của hợp chất hóa học này. Cấu trúc của nó được trình bày trong Hình 1 (EMBL-EBI, 2005). Do đó, hydro sunfua ít tan trong nước. Sau khi hòa tan, nó tạ
Kali sulfat , còn được gọi là arcanite, là một hợp chất hóa học có công thức là K 2 SO 4 . Cấu trúc của nó xuất hiện trong hình 1 (EMBL-EBI, 2014). Hợp chất này đã được biết đến từ đầu thế kỷ 14 và được nghiên cứu bởi Glauber, Boyle và Tachenius. Vào thế kỷ XVII, nó được gọi là arcanuni hoặc salt copyatum, vì nó l
Bạc cromat là hợp chất hóa học có công thức Ag 2 CrO 4 . Nó là một trong những hợp chất crom ở trạng thái oxy hóa (VI) và được cho là tiền thân của nhiếp ảnh hiện đại. Việc chuẩn bị các hợp chất là đơn giản. Điều này được tạo ra bởi một phản ứng trao đổi với một muối bạc hòa tan, chẳng hạn như giữa kali cromat và bạc nitrat (smrandy1956, 2012). 2AgNO 3 (aq) + Na 2 CrO 4 (aq) → Ag 2 CrO 4 (s) + 2NaNO 3 (aq) Hầu như tất cả các hợp chất kim loại kiềm
Axit carbonic , trước đây được gọi là axit không khí hoặc axit khí, là axit vô cơ duy nhất trong carbon và có công thức H2CO3. Các muối của axit carbonic được gọi là bicarbonat (hoặc hydro cacbonat) và cacbonat (Cơ sở dữ liệu chuyển hóa của con người, 2017). Cấu trúc của nó được trình bày trong Hình 1 (EMBL-EBI,
Natri thiosulfate hoặc natri hyposeulfite (Na 2 S 2 O 3) là một loại muối vô cơ quan trọng với nhiều công dụng y tế khác nhau. Nó cũng có sẵn dưới dạng muối pentahydrate của nó (Na 2 S 2 O 3 .5H 2 O). Nó là một hợp chất ion được hình thành bởi hai cation natri (Na +) và anion thiosulfate tích điện âm (S 2 O 3 -), trong đó nguyên tử lưu huỳnh trung tâm được liên kết với ba nguyên tử oxy và một nguyên tử lưu huỳnh khác (do đó tiền tố chú), thông qua các liên kết đơn giản và kép với ký tự cộng hưởng. Chất rắn tồn tại trong một cấu trúc tinh thể đơn hình. Natri thiosulfate có thể được điều chế bằng
Kali cromat là một hợp chất vô cơ có công thức K 2 CrO 4 , được đặc trưng như một tác nhân oxy hóa mạnh mẽ. Nó được điều chế bằng cách xử lý kali dicromat bằng kali hydroxit theo phản ứng: K 2 CrO 7 + 2KOH → 2K 2 CrO 4 + H 2 O. Là một hợp chất có cấu hình tương đối độc đáo, kali cromat có một số ứng dụng trong bối cảnh công nghiệp và khoa học. Tuy nhiên, do độc tính của nó, việc tiếp xúc với nó phải bị hạn chế (JACOBS, 2015). Tính chất
Ion amoni là một cation polyatomic tích điện dương có công thức hóa học là NH 4 +. Các phân tử không phẳng, nhưng có hình dạng của một tứ diện. Bốn nguyên tử hydro tạo thành bốn góc. Nitơ của amoniac có một cặp electron không chia sẻ có khả năng chấp nhận proton (bazơ Lewis), do đó ion amoni được hình thành do sự proton hóa amoniac theo phản ứng: NH 3 + H + → NH 4 + Amoni cũng được thay thế các amin thay thế hoặc các cation amoni thay thế. Ví dụ, methylammonium clorua là một muối ion có công thức CH 3 NH 4 Cl trong đó ion clorua được gắ
Axit pyruvic là một axit 2-oxo-monocarboxylic là dẫn xuất 2-keto của axit propionic. Công thức của nó là CH3COCOOH. Đây là loại axit alpha-keto đơn giản nhất, với axit cacboxylic và nhóm chức ketone. Cấu trúc của nó được trình bày trong Hình 1 (EMBL-EBI, 2017). Pyruvate, cơ sở liên hợp (CH3COCOO-) là một c