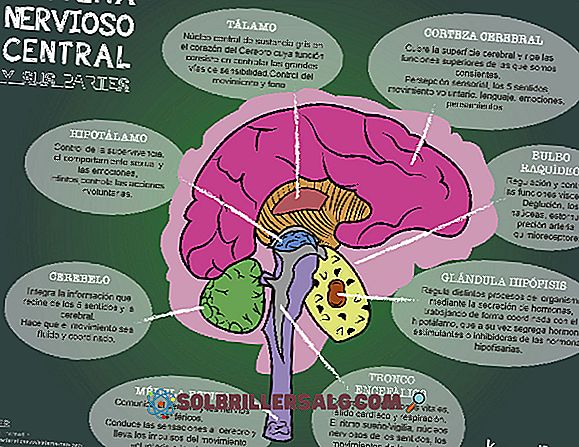
Kim loại kiềm thổ: Tính chất hóa học, phản ứng và ứng dụng
Các kim loại kiềm thổ là những kim loại tạo thành nhóm 2 của bảng tuần hoàn và được chỉ định trong cột màu tím của hình ảnh thấp hơn. Từ trên xuống dưới, chúng là berili, magiê, canxi, strontium, barium và radium. Để nhớ tên của họ, một phương pháp ghi nhớ tuyệt vời là phát âm của ông Becamgbara.
Phá vỡ các chữ cái của ông Becamgbara, người ta phải "Sr" là strontium. "Be" là biểu tượng hóa học của berili, "Ca" là biểu tượng của canxi, "Mg" là magiê và "Ba" và "Ra" tương ứng với các kim loại barium và radium, thứ hai là một nguyên tố của tự nhiên phóng xạ

Thuật ngữ "kiềm" dùng để chỉ các kim loại có khả năng tạo thành các oxit rất cơ bản; và mặt khác, "terre" dùng để chỉ những vùng đất, một cái tên được trao tặng vì độ hòa tan trong nước thấp. Những kim loại này ở trạng thái nguyên chất có màu bạc tương tự, được bao phủ bởi các lớp oxit xám hoặc đen.
Hóa học của kim loại kiềm thổ rất phong phú: từ sự tham gia cấu trúc của chúng trong nhiều hợp chất vô cơ đến các hợp chất gọi là hợp chất organometallic; Đây là những chất tương tác bằng liên kết cộng hóa trị hoặc phối hợp với các phân tử hữu cơ.
Tính chất hóa học
Về mặt vật lý, chúng cứng hơn, đặc hơn và chịu được nhiệt độ cao hơn so với kim loại kiềm (nhóm 1). Sự khác biệt này nằm ở các nguyên tử của chúng, hoặc cái giống nhau, trong cấu trúc điện tử của chúng.
Khi thuộc cùng một nhóm của bảng tuần hoàn, tất cả các đồng loại của chúng thể hiện tính chất hóa học xác định chúng là như vậy.
Tại sao? Bởi vì cấu hình hóa trị điện tử của nó là n s 2, có nghĩa là chúng có hai electron để tương tác với các loài hóa học khác.
Nhân vật ion
Do tính chất kim loại của chúng, chúng có xu hướng mất electron để tạo thành các cation hóa trị hai: Be2 +, Mg2 +, Ca2 +, Sr2 +, Ba2 + và Ra2 +.
Theo cùng một cách mà kích thước của các nguyên tử trung tính của nó thay đổi khi đi xuống qua nhóm, các cation của nó cũng trở nên lớn hơn đi xuống từ Be2 + đến Ra2 +.
Kết quả của sự tương tác tĩnh điện của chúng, các kim loại này tạo thành muối với các nguyên tố có độ âm điện lớn nhất. Xu hướng cao này để hình thành cation là một chất lượng hóa học khác của kim loại kiềm thổ: chúng rất nhiễm điện.
Các nguyên tử cồng kềnh phản ứng dễ dàng hơn các nguyên tử nhỏ; đó là Ra là kim loại dễ phản ứng nhất và là loại ít phản ứng nhất. Đây là sản phẩm của lực hấp dẫn thấp hơn do hạt nhân tác dụng lên các electron ngày càng xa, giờ đây có nhiều khả năng "thoát" sang các nguyên tử khác.
Tuy nhiên, không phải tất cả các hợp chất là ion trong tự nhiên. Ví dụ, berili rất nhỏ và có mật độ điện tích cao, phân cực đám mây điện tử của nguyên tử lân cận để tạo thành liên kết cộng hóa trị.
Hậu quả đó mang lại điều gì? Các hợp chất beryllium chủ yếu là cộng hóa trị và không ion, không giống như các hợp chất khác, ngay cả khi đó là cation Be2 +.
Liên kết kim loại
Bằng cách có hai electron hóa trị, chúng có thể tạo thành "biển electron" tích điện nhiều hơn trong các tinh thể của chúng, chúng tích hợp chặt chẽ hơn và nhóm các nguyên tử kim loại trái ngược với các kim loại kiềm.
Tuy nhiên, các liên kết kim loại này không đủ mạnh để cung cấp cho chúng các đặc tính độ cứng vượt trội, trên thực tế là mềm.
Ngoài ra, chúng còn yếu so với các kim loại chuyển tiếp, được phản ánh trong các điểm nóng chảy và sôi thấp hơn của chúng.
Phản ứng
Các kim loại kiềm thổ rất dễ phản ứng, đó là lý do tại sao chúng không tồn tại trong tự nhiên ở trạng thái tinh khiết, nhưng bị ràng buộc trong các hợp chất hoặc khoáng chất khác nhau. Các phản ứng đằng sau các thành tạo này có thể được tóm tắt chung cho tất cả các thành viên của nhóm này
Phản ứng với nước
Chúng phản ứng với nước (ngoại trừ berili, do "độ bền" của nó để cung cấp cặp electron của nó) để tạo ra hydroxit ăn mòn và khí hydro.
M (s) + 2H 2 O (l) => M (OH) 2 (ac) + H 2 (g)
Các hydroxit magiê -Mg (OH) 2 - và berili -Be (OH) 2 - hòa tan kém trong nước; Ngoài ra, cái thứ hai không phải là rất cơ bản, vì các tương tác là cộng hóa trị.
Phản ứng với oxy
Chúng đốt cháy tiếp xúc với oxy trong không khí để tạo thành các oxit hoặc peroxit tương ứng. Barium, kim loại có độ bay hơi thứ hai, tạo thành peroxide (BaO 2 ), ổn định hơn vì bán kính ion Ba2 + và O 2 2- tương tự nhau, củng cố cấu trúc tinh thể.
Phản ứng như sau:
2M (s) + O 2 (g) => 2MO (s)
Do đó, các oxit là: BeO, MgO, CaO, SrO, BaO và RaO.
Phản ứng với halogen
Điều này tương ứng với khi chúng phản ứng trong môi trường axit với các halogen tạo thành halogen vô cơ. Điều này có công thức hóa học chung MX 2, và trong số này là: CaF 2, BeCl 2, SrCl 2, BaI 2, RaI 2, CaBr 2, v.v.
Ứng dụng
Beryllium
Với khả năng phản ứng trơ của nó, berili là một kim loại có khả năng chống ăn mòn cao, và được thêm vào tỷ lệ nhỏ cho các hợp kim đồng hoặc niken với các tính chất cơ học và nhiệt thú vị cho các ngành công nghiệp khác nhau.
Trong số này có những loại hoạt động với dung môi dễ bay hơi, trong đó các công cụ không được tạo ra tia lửa do các cú sốc cơ học. Ngoài ra, hợp kim của nó được sử dụng trong việc phát triển tên lửa và vật liệu cho máy bay.
Magiê
Không giống như berili, magiê thân thiện với môi trường hơn và là một phần thiết yếu của thực vật. Vì lý do này, nó có tầm quan trọng sinh học cao và trong ngành công nghiệp dược phẩm. Ví dụ, magiê sữa là một phương thuốc cho chứng ợ nóng và bao gồm một dung dịch Mg (OH) 2 .
Nó cũng có các ứng dụng công nghiệp, chẳng hạn như hàn các hợp kim nhôm và kẽm, hoặc trong sản xuất thép và titan.
Canxi
Một trong những ứng dụng chính của nó là do CaO, phản ứng với aluminosilicat và canxi silicat để tạo ra xi măng và bê tông các đặc tính mong muốn của nó cho các tòa nhà. Nó cũng là một vật liệu cơ bản trong sản xuất thép, thủy tinh và giấy.
Mặt khác, CaCO 3 tham gia vào quá trình Solvay để tạo ra Na 2 CO 3 . Về phần mình, CaF 2 tìm thấy việc sử dụng trong sản xuất tế bào để đo quang phổ.
Các hợp chất canxi khác có công dụng trong chế biến thực phẩm, sản phẩm vệ sinh cá nhân hoặc mỹ phẩm.
Strontium
Khi đốt, strontium lóe lên một ánh sáng đỏ dữ dội, được sử dụng trong pháo hoa và để tạo ra pháo sáng.
Barium
Các hợp chất bari hấp thụ tia X, do đó BaSO 4 - cũng không hòa tan và ngăn Ba2 + độc hại được cơ thể giải phóng - được sử dụng để phân tích và chẩn đoán sự thay đổi trong quá trình tiêu hóa.
Đài phát thanh
Radium đã được sử dụng trong điều trị ung thư do tính phóng xạ của nó. Một số muối của nó đã được định sẵn để đồng hồ màu, sau đó cấm ứng dụng này vì những rủi ro cho những người mang chúng.